संतुलन एमडी
यूनिट 7
समान्यतः स्थिर
I. बहुविकल्पीय प्रश्न (प्रकार I)
~~ 1. हम जानते हैं कि $K_c$ और $K_p$ के बीच का सम्बन्ध है
$ K_p=K_c(RT)^{\Delta n} $
प्रतिक्रिया के लिए $\Delta n$ की मान क्या होगी?
$NH_4 Cl(s) \rightarrow NH_3(g)+HCl(g)$
(i) 1
(ii) 0.5
(iii) 1.5
(iv) 2
~~ 2. प्रतिक्रिया $H_2(g)+I_2(g) \rightarrow 2 HI(g)$ के लिए मानक मुक्त ऊर्जा $\Delta G^{\ominus}>0$ है। स्थिरस्थानीय संतुलन साझेदारी $(K)$ क्या होगी?
(i) $K=0$
(ii) $K>1$
(iii) $K=1$
(iv) $K<1$
~~ 3. निम्नलिखित में से कौन सा तर्किक प्रक्रियाओं को समान्यतः स्थिर नहीं है?
(i) समान्यतः स्थिरता केवल एक निर्धारित तापमान पर एक बंद प्रणाली में संभव होती है।
(ii) प्रणाली के सभी मापनीय गुणसूत्र स्थिर रहते हैं।
(iii) समान्यतः स्थिरता पर सभी भौतिक प्रक्रियाएं बंद हो जाती हैं।
(iv) प्रतिविरोधी प्रक्रियाएं एक ही दर पर होती हैं और गतिशील लेकिन स्थिर स्थिति होती है।
~~ 4. $PCl_5, PCl_3$ और $Cl_2$ को सामंजस्य में रखा गया है $500 K$ पर एक बंद बरतन में, और उनकी घनत्व $0.8 \times 10^{-3} mol L^{-1}, 1.2 \times 10^{-3} mol L^{-1}$ और $1.2 \times 10^{-3} mol L^{-1}$ हैं। प्रतिक्रिया के लिए $K_c$ का मान होगा
(i) $1.8 \times 10^{3} mol L^{-1}$
(ii) $1.8 \times 10^{-3}$
(iii) $1.8 \times 10^{-3} L mol^{-1}$
(iv) $0.55 \times 10^{4}$
~~ 5. निम्नलिखित में से कौन अवैध कथन है?
(i) समतापी मिश्रण में जमी हुई बर्फ और पानी की मास को समय के साथ बदलने की आवश्यकता नहीं होती है।
(ii) लाल रंग की तीव्रता वृद्धि होती है जब ऑक्सेलिक एसिड को एक वातावरण में जोड़ा जाता है जिसमें लोहे के साथ नाइट्रेट और पोटेशियम थायोसियानेट होता है।
(iii) उत्प्रेरक को जोड़ने पर स्थिरस्थानीय संतुलन साझेदारी का मान प्रभावित नहीं होता है।
(iv) जो रेखांकन $\Delta H$ मान के साथ नकारात्मक होता है, वह उच्च तापमान पर बढ़ता है।
~~ 6. जब हाइड्रोक्लोरिक एसिड को कोबाल्ट नाइट्रेट तत्व समाधान में कमरे के तापमान पर जोड़ा जाता है, तो निम्नलिखित प्रतिक्रिया होती है और प्रतिक्रिया मिश्रण नीला हो जाता है। मिश्रण को ठंडा करने पर यह गुलाबी हो जाता है। इस जानकारी के आधार पर सही उत्तर चुनें।
$[Co(H_2 O)_6]^{3+}(a q)+4 Cl^{-}(a q) \rightarrow[CoCl_4]^{2-}(a q)+6 H_2 O(l)$
(गुलाबी) (नीला)
(i) प्रतिक्रिया के लिए $\Delta H>0$ होता है
(ii) प्रतिक्रिया के लिए $\Delta H<0$ होता है
(iii) प्रतिक्रिया के लिए $\Delta H=0$ होता है
(iv) इस जानकारी के आधार पर $\Delta H$ का चिन्ह निर्धारित नहीं किया जा सकता है।
~~ 7. $25^{\circ} C$ पर न्यूट्रल पानी का $pH$ 7.0 होता है। जब तापमान बढ़ता है, तो पानी के आइनीकरण में वृद्धि होती है, हालांकि, $H^{+}$यों और $OH^{-}$यों की घनता समान होती है। $60^{\circ} C$ पर शुद्ध पानी का $pH$ क्या होगा?
(i) 7.0 के बराबर
(ii) 7.0 से अधिक
(iii) 7.0 से कम
(iv) शून्य के बराबर
~~
8. पानी का आयनीकरण संख्या, $K_a$, एक एम्ल की मजबूती का माप है। एसीटिक एम्ल, हाइपोक्लोरस एम्ल और फॉर्मिक एम्ल की $K_a$ मान्ये $1.74 \times 10^{-5}, 3.0 \times 10^{-8}$ और $1.8 \times 10^{-4}$ हैं। इन एम्लों के $0.1 आपूर्ति $ एम्ल के $pH$ के निम्न सदिशों में से कौनसा सही है?
(i) एसीटिक एम्ल $>$ हाइपोक्लोरस एम्ल $>$ फॉर्मिक एम्ल
(ii) हाइपोक्लोरस एम्ल $>$ एसीटिक एम्ल $>$ फॉर्मिक एम्ल
(iii) फॉर्मिक एम्ल $>$ हाइपोक्लोरस एम्ल $>$ एसीटिक एम्ल
(iv) फॉर्मिक एम्ल $>$ एसीटिक एम्ल $>$ हाइपोक्लोरस एम्ल
~~ 9. $K _{a_1}, K _{a_2}$ और $K _{a_3}$ निम्नलिखित प्रतिक्रियाओं के संबंधित आयनीकरण संख्याएं हैं।
$H_2 S \rightarrow H^{+}+HS$
$HS^{-} \rightarrow H^{+}+S^{2-}$
$H_2 S \rightarrow 2 H^{+}+S^{2-}$
$K _{a_1}, K _{a_2}$ और $K _{a_3}$ के बीच सही संबंध कौन सा है?
(i) $K _{a_3}=K _{a_1} \times K _{a_2}$
(ii) $K _{a_3}=K _{a_1}+K _{a_2}$
(iii) $K _{a_3}=K _{a_1}-K _{a_2}$
(iv) $K _{a_3}=K _{a_1} / K _{a_2}$
~~ 10. $BF_3$ की अम्लता निम्नलिखित सिद्धांतों के आधार पर समझाई जा सकती है?
(i) आरेनियस के सिद्धांत
(ii) ब्रॉन्स्टेड लोव्री के सिद्धांत
(iii) ल्यूइस के सिद्धांत
(iv) ब्रॉन्स्टेड लोव्री और ल्यूइस के सिद्धांत दोनों
~~ 11. इनमें से कौनसा मिश्रण बफर द्रव्य सक्षमता बनाएगा जबकि वे बराबर खुली मात्राओं में मिलाए जाएं?
(i) $0.1 मोल/लिटर NH_4 OH$ और $0.1 मोल/लिटर HCl$
(ii) $0.05 मोल/लिटर NH_4 OH$ और $0.1 मोल/लिटर HCl$
(iii) $0.1 मोल/लिटर NH_4 OH$ और $0.05 मोल/लिटर HCl$
(iv) $0.1 मोल/लिटर CH_4 COONa$ और $0.1 मोल/लिटर NaOH$
~~ 12. इनमें से कौनसे विलयन करने वाले पदार्थों में सबसे अधिक संक्रिय होगा?
(i) $0.1 मोल/लिटर AgNO_3$ विलयन
(ii) $0.1 मोल/लिटर HCl$ विलयन
(iii) $H_2 O$ विलयन
(iv) जलमय तुलनात्मक
~~ 13. $0.01 मोल/लिटर CH_3 COOH(K_a=1.74 \times 10^{-5})$ की $pH$ मान क्या होगा?
(i) 3.4
(ii) 3.6
(iv) 3.0
~~ 14. $CH_3 COOH$ के लिए $K_a$ $1.8 \times 10^{-5}$ और $NH_4 OH$ के लिए $K_b$ $1.8 \times 10^{-5}$ हैं। अमोनियम एसिटेट का $pH$ क्या होगा?
(i) 7.005
(ii) 4.75
(iii) 7.0
(iv) 6 और 7 के बीच
~~ 15. $A \rightarrow B$ के साधारणू उपस्थिति की स्थिति के लिए निम्नलिखित में से कौनसा विकल्प सही होगा।
(i) $\Delta G^{\ominus}=0$
(ii) $\Delta G^{\ominus}>0$
(iii) $\Delta G^{\ominus}<0$
(iv) $\Delta G^{\ominus}=-R T \ln 2$
~~ 16. दबाव बढ़ाने पर, द्रवगत प्रतिक्रिया स्थिरता को पुनः स्थापित करने के लिए किस दिशा में बढ़ेगी, यह ले शेटेलियर का सिद्धांत लागू करके पूर्वानुमान किया जाता है। निम्नलिखित प्रतिक्रिया को विचार करें।
$ N_2(g)+3 H_2(g) \rightarrow 2 NH_3(g) $
इससे कौन सा सही है, यदि विचार किए बिना तापमान बदलें और स्थापितता का योग प्रतिक्रिया पर बढ़ा दिया जाता है?
(i) $K$ वही रहेगा
(ii) $K$ कम होगा
(iii) $K$ बढ़ेगा
(iv) $K$ प्रारंभ में बढ़ेगा और दबाव बहुत उच्च होने पर कम होगा
17. जल, ऐसिटोन और ईथर के वाष्प दबाव का सही क्रम क्या होगा, $30^{\circ} C$ पर। इन कंपाउंड में जल का उबालने का सर्वाधिकारी बिंदु है और ईथर का सर्वाधिकारी सर्वाधिकारी बिंदु है?
(i) जल $<$ ईथर $<$ ऐसिटोन
(ii) जल $<$ ऐसिटोन $<$ ईथर
(iii) ईथर $<$ ऐसिटोन $<$ जल
(iv) ऐसिटोन $<$ ईथर $<$ जल
~~ 18. $500 K$ पर, संतुलन साधारित कोणीय, $K_c$, निम्नलिखित प्रतिक्रिया के लिए 5 है।
$\frac{1}{2} H_2(g)+\frac{1}{2} I_2(g) \rightarrow HI(g)$
प्रतिक्रिया के लिए संतुलन साधारित कोणीय $K_c$ क्या होगा
$2 HI(g) \rightarrow H_2(g)+I_2(g)$
(i) 0.04
(ii) 0.4
(iii) 25
(iv) 2.5
~~ 19. निम्नलिखित प्रतिक्रियाओं में से किसी एक प्रतिक्रिया पर संतुलन पर सामान्य वॉल्यूम में थोड़े से अर्गन के उपयोग पर कुछ प्रभाव नहीं पड़ेगा?
(i) $H_2(g)+I_2(g) \rightarrow 2 HI(g)$
(ii) $PCl_5(g) \rightarrow PCl_3(g)+Cl_2(g)$
(iii) $\quad N_2(g)+3 H_2(g) \rightarrow 2 NH_3(g)$
(iv) इन तीन तत्वों में संतुलन पर कोई प्रभाव नहीं पड़ेगा।
II. बहुविकल्पी प्रश्न (प्रकार-II)
निम्नलिखित प्रश्नों में दो या दो से अधिक विकल्प सही हो सकते हैं।
~~ 20. प्रतिक्रिया $N_2 O_4(g) \rightarrow 2 NO_2(g)$ के लिए, $K$ की मान $400 K$ पर 50 है और $500 K$ पर 1700 है। निम्नलिखित में से कौन सा विकल्प सही है?
(i) प्रतिक्रिया ऊष्मागामी है
(ii) प्रक्रिया उष्मागामी है
(iii) यदि $400 K$ पर $NO_2$ (g) और $N_2 O_4$ (g) को आपस में मिलाया जाता है तब भी $N_2 O_4(g)$ का अधिक निर्माण होगा।
(iv) प्रणीति का आपेक्षिकता बढ़ती है।
~~ 21. एक विशेष तापमान और वायुमंडलीय दबाव पर एक पवित्र पदार्थ की ठोस और तरल दशाएं संतुलन में हो सकती हैं। निम्नलिखित में से कौन सा शब्द इस तापमान को परिभाषित करता है?
(i) सामान्य पिघलाने का बिंदु
(ii) संतुलन तापमान
(iii) उबलने का बिंदु
(iv) जमने का बिंदु
III. संक्षेप उत्तर प्रकार
~~ 22. जल में हाइड्रोक्लोरिक के आईयोनीकरण का यह खंडन निम्नलिखित है:
$HCl(aq)+H_2 O(l) \rightarrow H_3 O^{+}(aq)+Cl^{-}(aq)$
इस आईयोनीकरण में दो संयुक्त अम्ल-आधार जोड़ीयों की छांटपट लेबल कीजिए।
~~ 23. शक्कर का द्रवजल में विद्युत नहीं चालता है। हालांकि, जब पानी में सोडियम क्लोराइड जोड़ा जाता है, तो यह विद्युत चालता है। इस कथन का आधार एवं इस पर सोडियम क्लोराइड की औद्यमिकता द्वारा इसका प्रभाव कैसे साबित करेंगे?
~~ 24. $BF_3$ में प्रोटॉन नहीं होता है लेकिन फिर भी यह एक अम्ल की तरह कार्य करता है और $NH_3$ के साथ प्रतिक्रिया करता है। ऐसा क्यों होता है? दोनों के बीच में कौन सा बंध बनता है?
~~ 25. एक कमजोर आधार $MOH$ की आयननीकरण स्थिरता स्थिति का मान निम्नानुसार होता है
$ K_b=\frac{[M^{+}][OH^{-}]}{[MOH]} $
केवल एक विशेष स्थिति में एक कमजोर आधार के आयननीयता के मान निम्नलिखित हैं:
| आधार | डाईमेथाइलएमिन | यूरिया | पिरिडीन | अमोनिया |
|---|---|---|---|---|
| $K_b$ | $5.4 \times 10^{-4}$ | $1.3 \times 10^{-14}$ | $1.77 \times 10^{-9}$ | $1.77 \times 10^{-5}$ |
समता पर उनकी आयननीयता के परिपट्थि के क्रम में व्यवस्थित कीजिए। इनमें से कौन सा आधार सबसे ताकतवर है?
26. कमजोर बेस की conjugate acid हमेशा मजबूत होती है। निम्नलिखित conjugate bases की बेसिक शक्ति कम होने की क्रमबद्धता क्या होगी?
$OH^{-}, RO^{-}, CH_3 COO^{-}, Cl^{-}$
~~ 27. निम्नलिखित को $pH$ के आदर्श क्रम में व्यवस्थित करें।
$ KNO_3(a q), CH_3 COONa(a q), NH_4 Cl(a q), C_6 H_5 COONH_4(a q) $
~~ 28. यौगिक प्रतिक्रिया $2 HI(g) \rightarrow H_2(g)+I_2(g)$ के लिए $K_c$ का मान $1 \times 10^{-4}$ है।
एक दिए गए समय पर, प्रतिक्रिया मिश्रण का समावेशं सहित होगा
$[HI]=2 \times 10^{-5} mol, \quad[H_2]=1 \times 10^{-5} mol$ और $[I_2]=1 \times 10^{-5} mol$
प्रतिक्रिया किस दिशा में प्रगति करेगी?
~~ 29. $pH=-\log [H^{+}]$ यह समीकरण के आधार पर, $HCl$ के $10^{-8} mol dm^{-3}$ वाले समाधान का $pH$ 8 होना चाहिए। हालांकि, यह कम से कम 7.0 से कम देखा गया है। कारण की व्याख्या करें।
~~ 30. एक तेज़ एम्ल द्रव का $pH$ 5.0 है। इस दिए गए द्रव को 100 गुना पानी से पतला करने के बाद द्रव का $pH$ क्या होगा?
~~ 31. एक संयमित असंबल नमक का विलयन केवल तब होता है जब यह उसके solution में आयनों की कंट्रेशन का गुणांक $(Q _{sp})$ उसके विप्लवता उत्पाद से अधिक हो जाता है। यदि $BaSO_4$ की विप्लवता $0.01 mol dm^{-3}$ के $H_2 SO_4$ में होती है, तो इसकी विप्लवता की गणना करें।
~~ 32. $0.08 mol dm^{-3} HOCl$ द्रव का $pH$ 2.85 है। उसकी विलोमन समस्त के लिए निर्धारित करें।
~~ 33. एक समाधान में दो समान आयतनों के दो समाधानों $A$ और $B$ के बराबर मात्राओं को मिलाकर जो समाधान बनाया गया है, उसका $pH$ क्या होगा? $A$ का $pH=6$ है और $B$ का $pH=4$ है।
~~ 34. $Al(OH)_3$ की विलोमन उत्पाद $2.7 \times 10^{-11}$ है। इसकी विलोमनता $gL^{-1}$ में और इस समाधान का $pH$ निकालें। ($Al$ का परमाणु चमत्कार $27 u$ है)।
~~ 35. एक विलयनशील वातानुक्रम $0.1 g$ लीड (II) क्लोराइड को विलयनशील समाधान प्राप्त करने के लिए कितने पानी की आवश्यकता होगी। $(PbCl_2$ का $K _{sp}.$ है $3.2 \times 10^{-8}$, $Pb$ का परमाणु चमत्कार $207 u$ है)।
~~ 36. नीचे दिए गए अवधरण अमोनिया और बोरन त्रिफ्लोराइड के बीच की एक प्रतिक्रिया को देती है:
$: NH_3+BF_3 \longrightarrow H_3 N: BF_3$
इस प्रतिक्रिया में अम्ल और बेस का पहचान करें। इसे कौनसा सिद्धांत समझाता है? उत्पादकों में $B$ और $N$ का hybridisation क्या होगी?
~~ 37. निम्नलिखित प्रतिक्रिया के लिए निम्नांकित आँतरिक हेट्स उपलब्ध हैं: $CaCO_3(s) \to CaO(s)+CO_2(g)$
$ \begin{aligned} & \Delta_f H^{\ominus}[CaO(s)]=-635.1 kJ mol^{-1} \\ & \Delta_f H^{\ominus}[CO_2(g)]=-393.5 kJ mol^{-1} \\ & \Delta_f H^{\ominus}[CaCO_3(s)]=-1206.9 kJ mol^{-1} \end{aligned} $
इस अवधरण के संतुलन स्थिति में उच्च तापमान का परिणाम क्या होगा?
IV. मिलान प्रकार
~~ 38. निम्नलिखित संतुलनों को संबंधित स्थिति के साथ मिलाएँ
| (i) तरल $\rightarrow$ वाष्प | (a) संतृप्त समाधान |
|---|---|
| (ii) ठोस $\leftrightharpoons$ तरल | (b) उबलने का बिंदु |
| (iii) ठोस $\leftrightharpoons$ वाष्प | (c) सुब्लाइकरण बिंदु |
| (iv) यथानिहित पदार्थ $(s) \leftrightharpoons$ पदार्थ समाधान | (d) पिघलने का बिंदु |
| (e) असंतृप्त समाधान |
~~
कॉलम I (प्रतिक्रिया) को कॉलम II (संतुलन स्थिति का सिद्धांत) के साथ मिलाएँ
| कॉलम I (प्रतिक्रिया) | कॉलम II (संतुलन स्थिति का सिद्धांत) |
|---|---|
| (i) $2 N_2(g)+6 H_2(g) \rightarrow 4 NH_3(g)$ | (a) $2 K_c$ |
| (ii) $\quad 2 NH_3(g) \rightarrow N_2(g)+3 H_2(g)$ | (b) $\quad K_c^{\frac{1}{2}}$ |
| (iii) $\quad \frac{1}{2} N_2(g)+\frac{3}{2} H_2(g) \rightarrow NH_3(g)$ | (c) $\frac{1}{K_c}$ |
| (d) $K_c^{2}$ |
~~ ४०. स्तंभित प्रतिक्रिया के प्रमाणिक मुक्त उर्जा को संयोजन स्थिति के समर्थक के साथ मिलाएँ
| (i) $\Delta G^{\ominus}>0$ | (a) $K>1$ |
|---|---|
| (ii) $\Delta G^{\ominus}<0$ | (b) $K=1$ |
| (iii) $\Delta G^{\ominus}=0$ | (c) $K=0$ |
| (d) $K<1$ |
~~ ४१. निम्नलिखित प्रजातियों को संयुक्त अम्ल के संतुलन सिद्धांत के साथ मिलाएँ
| प्रजाति | संयुक्त अम्ल |
|---|---|
| (i) $NH_3$ | (a) $CO_3^{2-}$ |
| (ii) $HCO_3^{-}$ | (b) $NH_4^{+}$ |
| (iii) $H_2 O$ | (c) $H_3 O^{+}$ |
| (iv) $HSO_4^{-}$ | (d) $H_2 SO_4$ |
| (e) $H_2 CO_3$ |
~~ ४२. निम्नलिखित ग्राफिकीय विचरण को उनकी विवरण से मिलाएँ
A
(i)
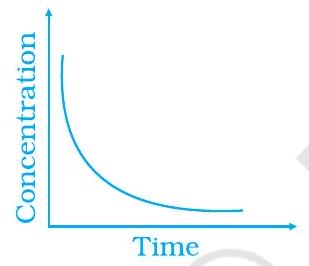
(ii)
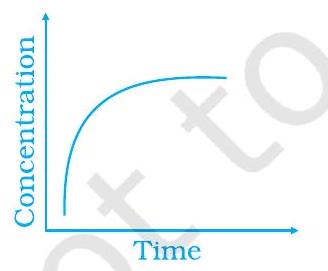
(iii)
(a) समय के साथ उत्पाद की उपयोगिता में विवेचना
(b) संतुलन परिक्रिया
(c) समय के साथ प्रतिक्रिया में उत्पाद की उपयोगिता में विवेचना
~~ ४३. कॉलम I को कॉलम II के साथ मिलाएँ
| कॉलम I | कॉलम II |
|---|---|
| (i) संतुलन | (a) $\Delta G>0, K<1$ |
| (ii) स्वेच्छिक प्रतिक्रिया | (b) $\Delta G=0$ |
| (iii) निर् |
विषय (R) : एक अस्थिात तत्विक जो एसेटिक एसिड और सोडियम एसिटेट का मिश्रण समावेशित करता है, $pH$ 4.75 के आसपास एक बफर समाधान के रूप में कार्य करता है।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही व्याख्यान है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही व्याख्यान नहीं है।
(iii) $A$ सत्य है लेकिन $R$ गलत है।
(iv) दोनों $A$ और $R$ गलत हैं।
~~ 46. वाद (A): जल में हाइड्रोजन सल्फाइड का आयनिकरण हाइड्रोक्लोरिक अम्ल की मौजूदगी में कम होता है।
कारण (R) : हाइड्रोजन सल्फाइड एक कमजोर अम्ल है।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही व्याख्यान है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही व्याख्यान नहीं है।
~~ 47. वाद (A): किसी विशेष तापमान पर किसी भी रासायनिक प्रतिक्रिया के लिए संतुलन सापेक्ष्ट मापीय निर्देशक एक निर्धारित और विशिष्ट गुण होता है।
कारण (R) : समतांत का निर्देशक तापमान पर निरपेक्ष है।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही व्याख्यान है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही व्याख्यान नहीं है।
(iii) $A$ सत्य है लेकिन $R$ गलत है।
(iv) दोनों $A$ और $R$ गलत हैं।
~~ 48. वाद (A) : अमोनियम कार्बोनेट की जलीय समाधानित अवस्था आधारभूत होती है।
कारण (R) : एक कमजोर अम्ल और कमजोर बेस के तत्व के जल के हल की अमित रिक्ति की मिलनसारता आधार पर अम्लीय / आलकली तत्व की प्रकृति पर निर्भर करती है।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही व्याख्यान है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही व्याख्यान नहीं है।
(iii) $A$ सत्य है लेकिन $R$ गलत है।
(iv) दोनों $A$ और $R$ गलत हैं।
~~ 49. वाद (A): अमोनियम एसिटेट का एक जलीय हल एक बफर के रूप में कार्य कर सकता है।
कारण (R) : एसेटिक एसिड एक कमजोर अम्ल है और $NH_4 OH$ एक कमजोर बेस है।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही व्याख्यान है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही व्याख्यान नहीं है।
(iii) $A$ गलत है लेकिन $R$ सत्य है।
(iv) दोनों $A$ और $R$ गलत हैं।
~~ 50. वाद (A): स्थिर दबाव और तापमान पर $PCl_5$ के विपदन में हीलीयम के जोड़ने से $PCl_5$ के विपदन में वियोजन बढ़ता है।
कारण (R) : हीलीयम $Cl_2$ को क्रिया के क्षेत्र से हटा देता है।
(i) दोनों $A$ और $R$ सत्य हैं और $R$ $A$ का सही व्याख्यान है।
(ii) दोनों $A$ और $R$ सत्य हैं लेकिन $R$ $A$ का सही व्याख्यान नहीं है।
(iii) $A$ सत्य है लेकिन $R$ गलत है।
(iv) दोनों $A$ और $R$ गलत हैं।
VI. लंबा उत्तर प्रकार
~~ 51. आप $K_c$ और $Q_c$ मान की तुलना करके एक प्रतिक्रिया के निम्नलिखित चरणों का पूर्वानुमान कैसे कर सकते हैं?
(i) नेट प्रतिक्रिया आगे की ओर बढ़ता है। (ii) नेट प्रतिक्रिया पिछे की ओर बढ़ता है।
(iii) कोई नेट प्रतिक्रिया नहीं होती है।
~~ 52. ले चाटेलियर सिद्धांत के आधार पर स्पष्ट करें कि ऊष्मा और दबाव को कैसे समायोजित किया जा सकता है ताकि निम्नलिखित प्रतिक्रिया में अमोनिया की उत्पादन बढ़ाई जा सके।
$N_2(g)+3 H_2(g) \rightarrow 2 NH_3(g) \quad \Delta H=-92.38 kJ mol^{-1}$
स्थिर आयाम में अर्गन के जोड़ने के परिणामस्वरूप क्या होगा?
~~
53. एक संक्षारणीय अल्पत्रिहीण लवण जिसका सामान्य सूत्र $A_x^{p+} B_y^{q-}$ है और मौलिक द्रव्यत्व के अनुसारता $S$ इसके परिपूर्ण समाधान के साथ संतुलन में है। इस तरह के लवण के लिए द्रव्यत्व और द्रव्यत्व गुणांक के बीच एक संबंध निर्धारित करें।
~~ 54. $\Delta G$ और $Q$ के बीच एक संबंध लिखें और प्रत्येक शब्द के अर्थ को परिभाषित करें और निम्नलिखित का उत्तर दें:
(a) $Q<K$ होने पर प्रतिक्रिया आगे बढ़ती है और $Q=K$ होने पर कोई रिअाँकन तकनीक नहीं होती है। इसका कारण क्या है?
(b) रिअाँटक्रिया $CO(g)+3 H_2(g) \rightarrow CH_4(g)+H_2 O(g)$ के रिअाँकन गुणांक $Q$ के माध्यम से बढ़ते दबाव के प्रभाव को समझाएं।
उत्तर
I. प्रश्न संख्या से चयन किया गया प्रश्न (प्रकार-I)
~~ 1. (iv)
~~ 2. (iv)
~~ 3. (iii)
~~ 4. (ii)
~~ 5. (ii)
~~ 6. (i)
~~ 7. (iii)
~~ 8. (iv)
~~ 9. (i)
~~ 10. (iii)
~~ 11. (iii)
~~ 12. (iv)
~~ 13. (i)
~~ 14. (iii)
~~ 15. (i) $\Delta G^{\ominus}=0$
स्पष्टीकरण: $\Delta G^{\ominus}=-R T \ln K$
प्रतिक्रिया के आधी प्रगति के चरण में $[A]=[B]$, इसलिए $K=1$।
इसलिए, $\Delta G^{\ominus}=0$
~~ 16. (i), स्पष्टीकरण: ले-चाटेलिये का सिद्धांत के अनुसार, स्थिर तापमान पर, संतुलन संयोजन बदलेगा लेकिन $K$ अभी भी समान रहेगा।
~~ 17. (ii)
~~ 18. (i)
~~ 19. (iv)
II. प्रश्न संख्या से चयन किया गया प्रश्न (प्रकार-II)
~~ 20. (i), (iii) और (iv)
स्पष्टीकरण: (i) वापसी तापमान के साथ बढ़ जाती है।
(iii) $Q>K$, इसलिए प्रतिक्रिया पिछड़े दिशा में प्रगति करेगी।
(iv) $\Delta n>0$, इसलिए $\Delta S>0$।
~~ 21. (i) और (iv)
III. छोटे संकेत प्रकार
~~ 22.
| $HCl$ | $Cl^{-}$ |
|---|---|
| अम्ल | संयुग्म का आधार |
| $H_2 O$ | $H_3 O^{+}$ |
| आधार | रेखीय अम्ल |
~~ 23.
-
चीनी पानी में आयोन नहीं करती है, लेकिन $NaCl$ पूर्णतः आयोन करता है और $Na^{+}$ और $Cl^{-}$ आयोन उत्पन्न करता है।
-
योग की गतिविधि में वृद्धि योग के वृद्धि के कारण उत्पन्न यों के अधिक आयोनॉज़ों के छुटकारे के कारण इकाई बढ़ती है।
~~ 24. $BF_3$ एक लवण आसिद होता है क्योंकि यह इलेक्ट्रॉन अभावी यौगिक है और उसमें संयुक्त अवरोही बंध निम्न रूप में बनाया जाता है:
$H_3 N: \to BF_3$
~~ 25.
- स्थिरता में समायोजन की क्रमबद्धता के क्रम में निम्न होती है:
डाईमिथाइलएमिन $>$ अमोनिया $>$ पिरिडीन $>$ यूरिया
- क्योंकि डाईमिथाइलएमिन सबसे अधिक स्थिरता मात्रा तक विकसित होगा, इसलिए यह चार दिए गए आधारों का सबसे मजबूत आधार है।
~~ 26. $RO^{-}>OH^{-}>CH_3 COO^{-}>Cl^{-}$
~~ 27. $NH_4 Cl<C_6 H_5 COONH_4<KNO_3<CH_3 COONa$
~~ 28. एक दिया गया समय में प्रतिक्रिया क्षेत्र के लिए प्रतिक्रिया निश्चयक कोष्ट $Q$ सद्य आवश्यकता से निर्धारित होगा।
$ \begin{aligned} Q & =\frac{[H_2][I_2]}{[H I]^{2}} \\ & =\frac{1 \times 10^{-5} \times 1 \times 10^{-5}}{(2 \times 10^{-5})^{2}}=\frac{1}{4} \\ & =0.25=2.5 \times 10^{-1} \end{aligned} $
प्रतिक्रिया कोष्ट के मान की मान्यता के मान से अधिक होने के कारण प्रतिक्रिया पिछड़े दिशा में प्रगति करेगी।
29. साधारित नमी का $10^{-8} \ मोल/ड्म^{-3}$ की आपूर्ति विलय से पता चलता है। इसलिए, पानी से $H_3 O^{+}$ की आपूर्ति योगदान महत्वपूर्ण होती है और $pH$ की गणना के लिए इसे भी शामिल किया जाना चाहिए।
~~ 30. (i) $pH=5$
$[H^{+}]=10^{-5} \ मोल/लिटर$
100 गुणा पतले करने पर
$[H^{+}]=10^{-7} \ मोल/लिटर$
आपूर्ति $[H^{+}]$ का $pH$ के समीकरण $pH=-\log [H^{+}]$ का उपयोग करके गणना करने पर, $pH$ की मान 7 आती है। यह संभव नहीं है। इससे पता चलता है कि विलय बहुत पतली है। इसलिए,
कुल हाइड्रोजन आयन आपूर्ति
$=[H^{+}]$
$ \begin{aligned} & =\begin{matrix} तत्वसंघ का \\ योगदान \\ H_3 O^{+} की \\ आपूर्ति \\ तत्वसंघ \\ \end{matrix} \\ & =10^{-7}+10^{-7} . \end{aligned}+\begin{aligned} & \text{ पानी की } \\ & H_3 O^{+} \text{की आपूर्ति} \\ \end{aligned} $
$pH=2 \times 10^{-7}=7-\log 2=7-0.3010=6.6990$
~~ 31.
$t=0$ पर
पानी में संतुलितता में
सल्फुरिक एसिड की उपस्थिति में संतुलितता में $\begin{matrix} बारियम सल्फेट(\text{s}) & \rightarrow बा^{2+}(\text{aq}) & +\underset{4}{सो_4^{2-}}(\text{aq}) \\ 1 & 0 & 0\end{matrix} $
$\begin{matrix} 1-S & S & S\end{matrix} $
$S \quad(S+0.01)$
$BaSO_4$ के लिए $K _{sp}$ पानी में $=[Ba^{2+}][SO_4^{2-}]=(S)(S)=S^{2}$
लेकिन $S=8 \times 10^{-4} \ मोल/ड्म^{-3}$ है
$\therefore K _{sp}=(8 \times 10^{-4})^{2}=64 \times 10^{-8}$ ……(1)
सल्फुरिक एसिड की उपस्थिति में $K _{sp}$ की प्रकटी कुल्यता निम्नांकन इस प्रकार होगी : $K _{sp}=(S)(S+0.01)$ ……. (2)
क्योंकि थोले $K _{sp}$ की मान बदलते नहीं होंगे, इसलिए (1) और (2) से
$(S)(S+0.01)=64 \times 10^{-8}$
$S^{2}+0.01 S=64 \times 10^{-8}$
$S^{2}+0.01 S-64 \times 10^{-8}=0$
$ \begin{aligned} & S=\frac{-0.01 \pm \sqrt{(0.01)^{2}+(4 \times 64 \times 10^{-8})}}{2} \\ &=\frac{-0.01 \pm \sqrt{10^{-4}+(256 \times 10^{-8})}}{2} \\ &=\frac{-0.01 \pm \sqrt{10^{-4}(1+256 \times 10^{-2})}}{2} \\ &=\frac{-0.01 \pm 10^{-2} \sqrt{1+0.256}}{2} \\ &=\frac{-0.01 \pm 10^{-2} \sqrt{1.256}}{2} \\ &=\frac{-10^{-2}+(1.12 \times 10^{-2})}{2} \\ &=\frac{(-1+1.12) \times 10^{-2}}{2}=\frac{0.12}{2} \times 10^{-2} \\ &=6 \times 10^{-4} \ मोल/ड्म^{-3} \end{aligned} $
~~ 32.
$HOCl$ का $pH=2.85$
लेकिन, $-pH=\log [H^{+}]$
$\therefore-2.85=\log [H^{+}]$
$\overline{3} .15=\log [H^{+}]$
$[H^{+}]=1.413 \times 10^{-3}$
कमजोर मोनो बेसिक अम्ल के लिए $[H^{+}]=\sqrt{K_a \times C}$
$ \begin{aligned} K_a & =\frac{[H^{+}]^{2}}{C}=\frac{(1.413 \times 10^{-3})^{2}}{0.08} \\ & =24.957 \times 10^{-6}=2.4957 \times 10^{-5} \end{aligned} $
~~ 33. समाधान $A$ का $pH=6$
इसलिए, $[H^{+}]$ आयन की आपूर्ति $A$ का $10^{-6} मोल/लिटर$ होगा
समाधान $B$ का $pH=4$
इसलिए, $[H^{+}]$ आयन की आपूर्ति $B$ का $10^{-4} मोल/लिटर$ होगा
एक लिटर हर प्रकार के समाधान को मिलाने पर, कुल आयतन द्रव्य का मात्रा $=1 \ लीटर+1 \ लीटर=2 \ लीटर$ होता है
समाधान $A$ के $1 \ लीटर$ में $H^{+}$ आयन की मात्रा $=$ आपूर्ति $\times$ आयतन $V$
$H^{+}$ आयन की मात्रा $=10^{-6} \times 1=10^{-6}$
समाधान $B$ के $1 \ लीटर$ में $H^{+}$ आयन की मात्रा $=$ आपूर्ति $\times$ आयतन $V$
$H^{+}$ आयन की मात्रा $=10^{-4} \times 1=10^{-4}$
दोनों समाधानों को मिलाने पर, कुल मात्रा $=10^{-6}+10^{-4}=1.01 \times 10^{-4}$
प्रस्तावित भिन्नता है, है
प्रस्तावित भिन्नता $=1.01 \times 10^{-4}-10^{-4}=0.01 \times 10^{-4}$
समाधान $A$ और $B$ को मिलाने के बाद कुल आयतन द्रव्य का मात्रा $=1 \ लीटर+1 \ लीटर=2 \ लीटर$ होता है
$H^{+}$ आयन की मात्रा $=\text{कुल भिन्नता}$ के बराबर होगी।
$1.01 \times 10^{-4} \ मोल/लिटर=0.01 \times 10^{-4} \ मोल/लिटर$
कंटेंट का हिंदी संस्करण क्या है: =10^{-6} mol \times 1 L $
लवणाग्रा $B$ के $1 L$ में $1 \cdot 10^{-4}$ mol $H^{+}$ आयन की मात्रा।
$\therefore$ मिश्रण $A$ और $B$ के द्वारा बने समाधान में कुल मात्रांक $H^{+}$ आयन $(10^{-6} mol+10^{-4} mol)$ है।
यह मात्रा 2L समाधान में मौजूद है।
$ \begin{aligned} & \therefore \text{ कुल }[H^{+}]=\frac{10^{-4}(1+0.01)}{2}=\frac{1.01 \times 10^{-4}}{2} mol L^{-1}=\frac{1.01 \times 10^{-4}}{2} mol L^{-1} \\ & =0.5 \times 10^{-4} mol L^{-1} \\ & =5 \times 10^{-5} mol L^{-1} \\ & pH=-\log [H^{+}]=-\log (5 \times 10^{-5}) \\ & =-[\log 5+(-5 \log 10)] \\ & =-\log 5+5 \\ & =5-\log 5 \\ & =5-0.6990 \\ & =4.3010=4.3 \end{aligned} $
~~ 34. $S$ को $Al(OH)_3$ की विच्छेदनशीलता मानें।
$ Al(OH)_3 \leftrightharpoons Al^{3+}(aq)+30 H^{-}(aq) $
$t=0$ पर अवधि पर स्पीषियों के घनत्व|1 | 0 |0 | स्थिरता पर विभिन्न स्पीषियों की घनत्व|1-S | S| 3S|
$ \begin{aligned} & K _{sp}=[Al^{3+}][OH^{-}]^{3}=(S)(3 S)^{3}=27 S^{4} \\ & S^{4}=\frac{K _{sp}}{27}=\frac{27 \times 10^{-11}}{27 \times 10}=1 \times 10^{-12} \\ & S=1 \times 10^{-3} mol L^{-1} \end{aligned} $
(i) $Al(OH)_3$ की विच्छेदनशीलता
$Al(OH)_3$ का मूलर मास $78 g$ है। इसलिए,
$Al(OH)_3$ की विच्छेदनशीलता $g L^{-1}=1 \times 10^{-3} \times 78 g L^{-1}=78 \times 10^{-3} g L^{-1}$
$ =7.8 \times 10^{-2} g L^{-1} $
(ii) माध्यम का $\mathbf{p H}$
$ \begin{aligned} & S=1 \times 10^{-3} mol L^{-1} \\ & {[OH^{-}]=3 S=3 \times 1 \times 10^{-3}=3 \times 10^{-3}} \\ & \text{ pOH }=3-\log 3 \\ & \text{ pH }=14-\text{ pOH }=11+\log 3=11.4771 \end{aligned} $
~~ 35. $PbCl_2$ का $K _{sp }=3.2 \times 10^{-8}$
$S$ को $PbCl_2$ की विच्छेदनशीलता मानें।
$ PbCl_2(s) \leftrightharpoons Pb^{2+}(aq)+2 Cl^{-}(aq) $
$t=0$ पर अवधि पर स्पीषियों के घनत्व|1|0|0| स्थिरता पर विभिन्न स्पीषियों की घनत्व|1-S|S|2S|
$K _{sp}=[Pb^{2+}][Cl^{-}]^{2}=(S)(2 S)^{2}=4 S^{3}$
$K _{sp}=4 S^{3}$
$S^{3}=\frac{K _{sp}}{4}=\frac{3.2 \times 10^{-8}}{4} mol L^{-1}=8 \times 10^{-9} mol L^{-1}$
$S=\sqrt[3]{8 \times 10^{-9}}=2 \times 10^{-3} mol L^{-1} \quad S=2 \times 10^{-3} mol L^{-1}$
$PbCl_2$ का मूलर मास $278$
$\therefore PbCl_2$ की विच्छेदनशीलता $g L^{-1}=2 \times 10^{-3} \times 278 g L^{-1}$
$ \begin{aligned} & =556 \times 10^{-3} g L^{-1} \\ & =0.556 g L^{-1} \end{aligned} $
संतृप्त समाधान प्राप्त करने के लिए, $1 L$ पानी में $0.556 g$ $PbCl_2$ विलयन किया जाएगा।
$0.1 g PbCl_2$ को $\frac{0.1}{0.556} L=0.1798 L$ पानी में विलय किया जाता है।
संतृप्त समाधान प्राप्त करने के लिए, $0.1 g$ $PbCl_2$ विलय किए जाने के लिए, $0.1798 L \approx 0.2 L$ पानी की आवश्यकता होगी।
~~ 37. $\Delta_r H^{\ominus}=\Delta_f H^{\ominus}[CaO(s)]+\Delta_f H^{\ominus}[CO_2(g)]-\Delta_f H^{\ominus}[CaCO_3(s)]$
$\therefore \Delta_r H^{\ominus}=178.3 kJ mol^{-1}$
प्रतिक्रिया उष्णर क्रिया है। इसलिए, लेशाटेलिये के सिद्धांत के अनुसार, उष्णता बढ़ाते हुए प्रतिक्रिया आगे की ओर बढ़ेगी।
IV. मिलान के प्रकार
~~ 38. (i) $\to$ (बी) $\quad$ (ii) $\to$ (डी) $\quad$ (iii) $\to$ (सी) $\quad$ (iv) $\to$ (ए)
~~ 39. (i) $\to$ (डी) $\quad$ (ii) $\to$ (सी) $\quad$ (iii) $\to$ (बी)
~~ 40. (i) $\to$ (डी) $\quad$ (ii) $\to$ (ए) $\quad$ (iii) $\to$ (बी)
~~ 41. (i) $\to$ (बी) $\quad$ (ii) $\to$ (ई) $\quad$ (iii) $\to$ (सी) $\quad$ (iv) $\to$ (डी)
~~ 42. (i) $\to$ (सी) $\quad$ (ii) $\to$ (ए) $\quad$ (iii) $\to$ (बी)
~~ 43. (i) $\to$ (बी) और (सी) $\quad$ (ii) $\to$ (डी) $\quad$ (iii) $\to$ (ए)
V. दावा और कारण प्रकार
~~ 44. (i)
~~ 45. (i)
~~ 46. (ii)
~~ 47. (iii)
~~ 48. (i)
~~ 49. (iii)
~~ 50. (iv)
~~ V. लंबा उत्तर प्रकार
~~ 51. (i) G $ _{c}<K_c$
(ii) $Q_c>K_c$
(iii) $\beta_c=K_c$
यहां, $Q_c$ संतुष्टि मान रूप में वातावरणीय एकांत है और $K_c$ संतुष्टि स्थिरांक है।
~~ 53. $[.$ संकेत : $A_x^{p+} B_y^{q-} \rightarrow x A^{p+}(aq)+y B^{q-}(aq)$
$S$ मोल $A_x B_y$ विलय होकर $x S$ मोल $A^{p+}$ और $y S$ मोल $B^{q}$ देता है।]
~~ 54. $\Delta G=\Delta G^{\ominus}+R T \ln Q$
$\Delta G^{\ominus}=$ प्रतिक्रिया आगे बढ़ते हुए नि:शुल्क ऊर्जा का परिवर्तन
$\Delta G=$ मानक नि:शुल्क ऊर्जा का परिवर्तन
$Q=$ प्रतिक्रिया संतोष गणक
$R=$ गैस संख्या
$T=$ वास्तविक तापमान
क्योंकि $\Delta G^{\ominus}=-R T \ln K$
इसलिए $\Delta G=-R T \ln K+R T \ln Q=RT \ln \frac{Q}{K}$
यदि $Q<K, \Delta G$ ऋणात्मक होगा। प्रतिक्रिया आगे की ओर बढ़ती है।
यदि $Q=K, \Delta G=0$, कोई निकट प्रतिक्रिया नहीं।
[संकेत: अगले में $Q$ को $CO, H_2, CH_4$ और $H_2 O$ की गहनता के संबंध में जोड़ें (बढ़ी हुई दबाव)। दिखाएं कि $Q<K$ और इसलिए प्रतिक्रिया आगे की ओर बढ़ती है।]





