इलेक्ट्रोकेमिस्ट्री एमडी
{इकाई 3 }
विद्युतरसायनशास्त्र
I. बहुविकल्पीय प्रश्न (प्रकार-I)
~~
- कौपर प्रेतरी के मानक प्रेतभूतपोटेशियल को कौनसा सेल मापेगा?
(i) $Pt$ (s) $\mid H_2$ (g,0.1 बार) $\mid H^{+}$(aq., $.1 M) | Cu^{2+}$ (aq., 1M) $\mid Cu$
(ii) $Pt$ (s) $\mid H_2$ (g, 1 बार) $\mid H^{+}$(aq., $1 M$ ) $| Cu^{2+}$ (aq., $2 M$ ) $\mid Cu$
(iii) $Pt$ (s) $\mid H_2$ (g, 1 बार) $\mid H^{+}$(aq., $1 M$ ) $| Cu^{2+}$ (aq., $1 M$ ) $\mid Cu$
(iv) $Pt(s) \mid H_2$ (g, 1 बार) $\mid H^{+}$(aq.,0.1 M) $| Cu^{2+}$ (aq., $.1 M) \mid Cu$
~~ 2. $Mg$ प्रेतरी का प्रेतभूतपोटेशियल समीकरण के अनुसार बदलता है
$E_{Mg^{2+} \mid Mg}=E_{Mg^{2+} \mid Mg}^{\ominus}-\frac{0.059}{2} \log \frac{1}{[Mg^{2+}]}$. $E_{Mg^{2+} \mid Mg}$ और $\log [Mg^{2+}]$ के ग्राफ़ का निर्माण है
(i)
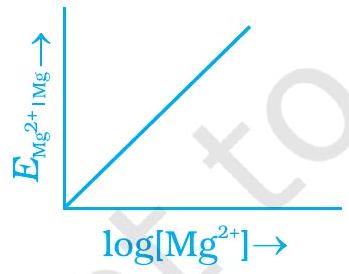
(iii)
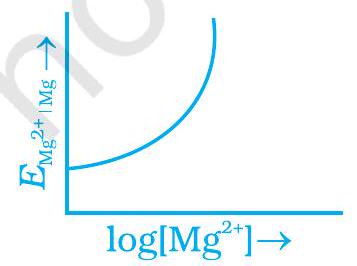
(ii)
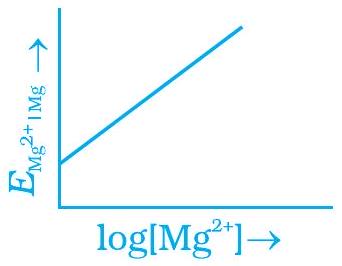
(iv)
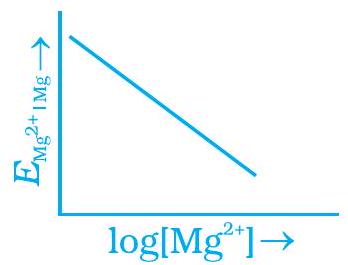
~~ 3. निम्नलिखित में से कौनसा कथन सही है?
(i) $E_{\text {सेल }}$ और $\Delta_{r} G$ सेल प्रतिक्रिया दोनों व्यापक गुण हैं।
(ii) $E_{\text {सेल }}$ और $\Delta_{r} G$ सेल प्रतिक्रिया दोनों सघन गुण हैं।
(iii) $\quad E_{\text {सेल }}$ एक सघन गुण है, जबकि $\Delta_{r} G$ सेल प्रतिक्रिया व्यापक गुण है।
(iv) $E_{\text {सेल }}$ एक व्यापक गुण है जबकि $\Delta_{r} G$ सेल प्रतिक्रिया एक सघन गुण है।
~~ 4. कोशिका के माध्यम से कोई विद्युत नहीं निकाला जाता है तब दो प्रेतों के प्रेतभूतपोटेशियल के बीच का अंतर को कहते हैं
(i) कोशिका पोटेशियल
(ii) कोशिका ईएमएफ
(iii) पोटेशियल अंतर
(iv) कोशिका वोल्टेज
~~ 5. निम्नलिखित में से एक निष्क्रिय प्रेत में एक गलत कथन है?
(i) यह सेल प्रतिक्रिया में भाग नहीं लेता है।
(ii) यह ऑक्सीकरण या अवकरण प्रतिक्रिया के लिए सतह प्रदान करता है।
(iii) यह इलेक्ट्रॉनों के चंदन के लिए पृष्ठ प्रदान करता है।
(iv) यह रेडोक्स प्रतिक्रिया के लिए पृष्ठ प्रदान करता है।
~~ 6. विद्युतरसायनिक कोशिका अवस्था इलेक्ट्रॉलिटिक कोशिका की तरह व्यवहार कर सकती है जब
(i) $E_{\text {सेल }}=0$
(ii) $E_{\text {सेल }} > E_{\text {बाह्य }}$
(iii) $E_{\text {बाह्य }} > E_{\text {सेल }}$
(iv) $E_{\text {सेल }}=E_{\text {बाह्य }}$
~~ 7. निम्नलिखित कथनों में से विलययोग्य पदार्थों के विलय तंत्र के बारे में कौनसा कथन सही नहीं है?
(i) विलयगति समाधान का आकार पर निर्भर करती है।
(ii) विलयगति विलय समाधान का आधार करती है।
(iii) विलयगति विलय समाधान के सोलवेशन पर निर्भर नहीं होती है।
(iv) विलयगति समाधान का तापमान के साथ बढ़ता है।
~~ 8. नीचे दिए गए डेटा का उपयोग करके सबसे शक्तिशाली घटाने वाला एजेंट खोजें।
$ \begin{matrix}
उन्होंने पूछा कि कॉंटेंट का हिन्दी संस्करण क्या है:
$E_{Cr_2 O_7^{2-} / Cr^{3+}}^{\ominus}=1.33 V \quad & \quad E_{Cl_2 / Cl^{-}}^{\ominus}=1.36 V \\ E_{MnO_4^{\ominus} / Mn^{2+}}^{\ominus}=1.51 V \quad & \quad E_{Cr^{3+} / Cr}^{\ominus}=-0.74 V \end{matrix} $
(i) $Cl^{-}$
(ii) $Cr$
(iii) $Cr^{3+}$
(iv) $Mn^{2+}$
~~ 9. $Q .8$ में दिए गए डेटा का उपयोग करें और निम्नलिखित में से कौन सा सबसे तेज ऑक्साइडाइजिंग एजेंट है।
(i) $Cl^{-}$
(ii) $Mn^{2+}$
(iii) $MnO_4^{-}$
(iv) $Cr^{3+}$
~~ 10. $Q .8$ में दिए गए डेटा का उपयोग करें और निम्नलिखित विकल्प में कौन सा ऑर्डर सही है।
(i) $Cr^{3+}<Cl^{-}<Mn^{2+}<Cr$
(ii) $Mn^{2+}<Cl^{-}<Cr^{3+}<Cr$
(iii) $Cr^{3+}<Cl^{-}<Cr_2 O_7^{2-}<MnO_4^{-}$
(iv) $Mn^{2+}<Cr^{3+}<Cl^{-}<Cr$
~~ 11. $Q .8$ में दिए गए डेटा का उपयोग करें और सबसे स्थिर आयन का पता लगाएं।
(i) $Cl^{-}$
(ii) $Cr^{3+}$
(iii) $Cr$
(iv) $Mn^{2+}$
~~ 12. $Q .8$ में दिए गए डेटा का उपयोग करें और सबसे स्थिर ऑक्सीडाइज्ड स्पीस का पता लगाएं।
(i) $Cr^{3+}$
(ii) $MnO_4^{-}$
(iii) $Cr_2 O_7^{2-}$
(iv) $Mn^{2+}$
~~ 13. $Al_2 O_3$ से एक मोल एल्यूमिनियम प्राप्त करने के लिए आवश्यक राशि है
(i) $1 F$
(ii) $6 F$
(iii) $3 F$
(iv) $2 F$
~~ 14. एक विद्युत चालकता सेल का सेल संयोजक स्थिर बना रहता है
(i) इलेक्ट्रोलाइट के परिवर्तन के साथ परिवर्तित होता है।
(ii) इलेक्ट्रोलाइट के घनत्व के साथ परिवर्तित होता है।
(iii) इलेक्ट्रोलाइट के तापमान के साथ परिवर्तित होता है।
(iv) एक सेल के लिए स्थिर रहता है।
~~ 15. पीबी संग्रह बैटरी को चार्ज करते समय
(i) $PbSO_4$ एनोड से $Pb$ में घटित हो जाता है।
(ii) $PbSO_4$ कैथोड से $Pb$ में घटित हो जाता है।
(iii) $PbSO_4$ कैथोड से $Pb$ में ऑक्सीकरण होता है।
(iv) $PbSO_4$ एनोड से $PbO_2$ में ऑक्सीकरण होता है।
~~ 16. $\Lambda_{m(NH_4 OH)}^{0}$ बराबर है
(i) $\quad \Lambda_{m(NH_4 OH)}^{0}+\Lambda_{m(NH_4 Cl)}^{0}-\Lambda_{(HCl)}^{0}$
(ii) $\quad \Lambda_{m(NH_4 Cl)}^{0}+\Lambda_{m(NaOH)}^{0}-\Lambda_{(NaCl)}^{0}$
(iii) $\quad \Lambda_{m(NH_4 Cl)}^{0}+\Lambda_{m(NaCl)}^{0}-\Lambda_{(NaOH)}^{0}$
(iv) $\quad \Lambda_{m(NaOH)}^{0}+\Lambda_{m(NaCl)}^{0}-\Lambda_{(NH_4 Cl)}^{0}$
~~ 17. नाट्रियम क्लोराइड के जलीय नाइट्रोसाइड विलय में किसी भी आयन द्वीप में सिरा संयंत्रण के पोलर के साथ यांत्रिकीय क्रिया का प्रदर्शन करेगा?
(i) $\quad Na^{+}(aq)+e^{-} \longrightarrow Na(s) ; \quad E_{\text {Cell }}^{\ominus}=-2.71 V$
(ii) $\quad 2 H_2 O(l) \longrightarrow O_2(g)+4 H^{+}(aq)+4 e^{-} ; E_{\text {Cell }}^{\ominus}=1.23 V$
(iii) $H^{+}(aq)+e^{-} \longrightarrow \frac{1}{2} H_2(g) ; \quad E_{\text {Cell }}^{\ominus}=0.00 V$
(iv) $\quad Cl^{-}(aq) \longrightarrow \frac{1}{2} Cl_2(g)+e^{-} ; \quad E_{\text {Cell }}^{\ominus}=1.36 V$
II. बहुविकल्पीय प्रश्न (प्रकार-II)
नोट: इसके बाद के प्रश्नों में दो या दो से अधिक विकल्प सही हो सकते हैं।
~~ 18. $Cu^{2+} / Cu$ के मानक इलेक्ट्रोड संबंध के साथ का पॉजिटिव मान दिखाता है कि
(i) यह रेडक्स कपल $H^{+} / H_2$ कपल से अधिक तापक प्रतिष्ठान है।
(ii) यह रेडक्स कपल $H^{+} / H_2$ कपल से अधिक आपदाकारी तत्त्व है।
(iii) $Cu$ एसिड से $H_2$ को बाहर नहीं निकाल सकता है।
(iv) $Cu$ एसिड से $H_2$ निकाल सकता है नहीं।
~~
- १९. $E_{\text {कोशिका }}^{\ominus}$ के लिए कुछ आदान-प्रदान भाग-कोशिकाएँ नीचे दी गई हैं। इन आधारों पर सही उत्तर को चिह्नित करें।
(a) $H^{+}(aq)+e^{-} \longrightarrow \frac{1}{2} H_2(g) ; \quad \quad E_{\text {कोशिका }}^{\ominus}=0.00 V$ (b) $\quad 2 H_2 O(l) \longrightarrow O_2(g)+4 H^{+}(aq)+4 e^{-} ; \quad E_{\text {कोशिका }}^{\ominus}=1.23 V$
(c) $2 SO_4^{2-}(aq) \longrightarrow S_2 O_8^{2-}(aq)+2 e^{-} ; \quad E_{\text {कोशिका }}^{\ominus}=1.96 V$
(i) पतले नमीनतम नदीमक सल्फुरिक अम्ल या हिंगुले में, अधिजलीय विद्युतचुंबक द्वारा हाइड्रोजन क्याथोड पर कम किया जाएगा।
(ii) सघन सल्फुरिक अम्ल या हिंगुले में, जल एनोड पर जलपान होगा।
(iii) नमीनतम नदीमक सल्फुरिक अम्ल या हिंगुले में, जल एनोड पर जलपान होगा।
(iv) नमीनतम नदीमक सल्फुरिक अम्ल या हिंगुले में, $SO_4^{2-}$ आयन एनोड पर चौ:साथी आयन तक ऑक्सीकरण किया जाएगा।
- डेनियल सेल के लिए $E_{\text {कोशिका }}^{\ominus}=1.1 V$। इस कोशिका में संतुलन की अवस्था का सही विवरण कौन सी है?
(i) $1.1=K_{c}$
(ii) $\frac{2.303 R T}{2 F} \log K_{c}=1.1$
(iii) $\log K_{c}=\frac{2.2}{0.059}$
(iv) $\log K_{c}=1.1$
- विद्युत्प्रचार्य सल्तन्त्र की आंदोलनशीलता पर निर्भरता होती है
(i) विद्युत्प्रचार्य की प्रकृति।
(ii) विद्युत्प्रचार्य की सामग्री का प्रकार।
(iii) प्रवर्धित विद्युत्रूप की शक्ति।
(iv) इलेक्ट्रोडों के बीच की दूरी।
- $\Lambda_m^{0} H_2 O $ बराबर है
(i) $\quad \Lambda_{m(HCl)}^{0}+\Lambda_{m(NaOH)}^{0}-\Lambda_{m(NaCl)}^{0}$
(ii) $\quad \Lambda_{m(HNO_3)}^{0}+\Lambda_{m(NaNO_3)}^{0}-\Lambda_{m(NaOH)}^{0}$
(iii) $\quad \Lambda_{(HNO_3)}^{0}+\Lambda_{m(NaOH)}^{0}-\Lambda_{m(NaNO_3)}^{0}$
(iv) $\quad \Lambda_{m(NH_4 OH)}^{0}+\Lambda_{m(HCl)}^{0}-\Lambda_{m(NH_4 Cl)}^{0}$
- प्लैटिनम इलेक्ट्रोड का उपयोग करके $CuSO_4$ के जलीय विलयन के दौरान क्या होगा?
(i) कॉपर कैथोड पर तत्ता जमा होगा।
(ii) कॉपर एनोड पर तत्ता जमा होगा।
(iii) एनोड पर ऑक्सीजन मुक्त होगा।
(iv) कॉपर एनोड पर पिघल जाएगा।
- $Cu$ इलेक्ट्रोडों के मौजूदगी में $CuSO_4$ के जलीय विलयन के दौरान क्या होगा?
(i) कॉपर कैथोड पर तत्ता जमा होगा।
(ii) कॉपर एनोड पर पिघल जाएगा।
(iii) एनोड पर ऑक्सीजन मुक्त होगा।
(iv) कॉपर एनोड पर तत्ता जमा होगा।
- निदेशकता $\kappa$ बराबर है
(i) $\frac{1}{R} \frac{l}{A}$
(ii) $\frac{G^{*}}{R}$
(iii) $\Lambda_{m}$
(iv) $\frac{l}{A}$
- आयनिक विलयन की मोलर निदेशकता निर्भर होती है
(i) तापमान।
(ii) इलेक्ट्रोडों के बीच की दूरी।
(iii) विलयनीय पदार्थों की घटकता।
(iv) इलेक्ट्रोडों के सतह का क्षेत्रफल।
- दिए गए कोश में, $Mg|Mg^{2+} | Cu^{2+}| Cu$
(i) $Mg$ कैथोड है
(ii) $Cu$ कैथोड है
(iii) कोशिका प्रतिक्रिया $Mg+Cu^{2+} \longrightarrow Mg^{2+}+Cu$ है
(iv) $Cu$ ऑक्सीकरणकारी एजेंट है
III. संक्षेप में उत्तर की प्रकार
- क्या किसी इलेक्ट्रोड का सच्चा कोशिका क्षेत्रीय स्थान मापा जा सकता है?
- क्या $E_{\text {कोशिका }}^{\ominus}$ या $\Delta_{r} G^{\ominus}$ कभी कोशिका प्रतिक्रिया के लिए शून्य हो सकते हैं?
-
$E_{\text {कोशिका }}=0$ या $\Delta_{r} G=0$ के क्या शर्त हैं?
-
व्यंजक में नकारात्मक चिह्न का क्या अर्थ होता है?
~~ 32. अलग-अलग वैद्युतिक कोशिकाओं में 1 एम्पियर करंट के लिए 10 मिनट तक आक्वियस कॉपर सल्फेट समाधान और आक्वियस सिल्वर नाइट्रेट समाधान को इलेक्ट्रोलाइज किया जाता है। क्या कॉपर और सिल्वर के भार कोथ पृर्णायनी में उत्पन्न होते हैं? अपनी उत्तर की व्याख्या करें।
~~ 33. चित्रित करें जिसमे सेल का अवरोधित प्रतिक्रिया $Cu+2 Ag^{+} \longrightarrow 2 Ag+Cu^{2+}$ होती है।
~~ 34. $Cl^{-}$ आयनों के ऑक्सीकरण के लिए मानक इलेक्ट्रोडों की मानक इलेक्ट्रोडी विभाजन से अधिक सकारात्मक होता है पानी के उससे भी। फिर भी आक्वियस सोडियम क्लोराइड की प्रिकृति में पानी के स्थान पर $Cl^{-}$ को एनोड पर ऑक्सीडाइज क्यों?
~~ 35. इलेक्ट्रोड प्रतिस्थापन क्या है?
~~ 36. निम्नलिखित चित्र में एक इलेक्ट्रो-रासायनिक कोशिका को वैद्युतिक कोशिके के साथ कपड़ा है। प्रादेशिक कोशिके के विभाजन ’ $ए$ ’ और ’ $बी$ ’ का प्रकार क्या होगा?
चित्र 3.1
~~ 37. विद्युत धारा को बमिलाती में रेजिस्टेंस का मापन क्यों किया जाता है क्रम्भिक धारा के लिए?
~~ 38. एक वैद्युतिक कोशिका का विद्युतीय पोषण $1.1 V$ होता है। यदि इस कोशिका पर $1.1 V$ विरोधी पोषण लागू किया जाए, तो कोशिका की प्रतिक्रिया और कोशिका के माध्याम से वर्तमान धारा में क्या होगा?
~~ 39. इसको इलेक्ट्रोलाइज किया जाने पर बारूड़ फ़्लूआसिड के प्रेक्षाग आईयोन होंगे, क्या $pH$ बारूड़ (aq. $NaCl$ समाधान) का प्रभावित क्या होगा?
~~ 40. सूखी कोशिका के विपरीत, एक अमालगम सूजी कोशिका की उपयोगी जीवन के दौरान एक स्थिर कोशिका संभवतः है। क्यों?
~~ 41. दो प्रेरकों की औरतें ‘ए’ और ‘बी’ के हलकी पदार्थ को वाणिज्यिक किया गया है। ’ $बी$ ’ के $\Lambda_{m}$ $1.5$ गुना बढ़ता है जबकि ’ $ए$ ’ का $25$ गुना बढ़ता है। दोनों में से कौन सा कठोर प्रेरक है? अपनी उत्तर की व्याख्या करें।
~~ 42. जब अम्लीकृत पानी (डिल्यूटेड $ह_2 स_4$ समाधान) को विद्युतीकरणित किया जाता है, तो क्या विद्युतीयक द्राव्य का $pH$ प्रभावित होगा? अपनी उत्तर की व्याख्या करें।
~~ 43. निम्नलिखित आक्वियस समाधान में विद्युतचालकों की विशिष्ट चालकता जल जोड़ने से कैसे बदलेगी?
~~ 44. अन्य इलेक्ट्रोडों के इलेक्ट्रोड प्रतिस्थापित करने के लिए किस संदर्भ इलेक्ट्रोड का उपयोग किया जाता है?
~~ 45. बट्टी को निम्नलिखित सेल को विचार करें
$Cu|Cu^{2+}||Cl^{-}| Cl_2, Pt$
एनोड पर और कैथोड पर गेटियन के उत्पन्न होने वाले प्रतिक्रियाओं को लिखें
~~ 46. डनियल सेल में सेल प्रतिक्रिया के लिए नर्नेस्ट समीकरण लिखें। जब $Zn^{2+}$ आयोनों की घनत्वा बढ़ती है, तो $E_{\text {Cell }}$ प्रभावित कैसे होगा?
~~ 47. प्राथमिक और सेकेंडरी बैटरियों के मुकाबले ईधन कोशिकाओं के पास क्या लाभ है?
~~ 48. केवल लीड संचय बैटरी की सेल प्रतिक्रिया जब यह संतोषित हो जाती है तो पाणी की घनत्वा मैं कैसे बदलती है?
~~ 49. को भिलाने पर $CH_3 COOH$ का $\Lambda_{m}$ काफी तेजी से बढ़ जाता है, जबकि $CH_3 COONa$ का $\Lambda_{m}$ धीरे-धीरे बढ़ता है?
what is the hi version of content: (ii) $E_{\text {Cell }}$
(iii) $\kappa$
(iv) G*
Column II
(a) $S cm^{-1}$
(b) $m^{-1}$
(c) $S cm^{2} mol^{-1}$
(d) $\quad V$
~~ 51. Match the terms given in Column I with the items given in Column II.
Column I
(i) $\Lambda_{m}$
(ii) $E_{\text {Cell }}^{\ominus}$
(iii)$ \kappa $
(iv) $\Delta_{r} G_{\text {Cell }}$
Column II
(a) मात्रिक गुण
(b) आयोनों की संख्या / आयतन
(c) सापेक्ष गुण
(d) पतला होने पर बढ़ता है
~~ 52. Match the items of Column I and Column II.
Column I
(i) लीड स्टोरेज बैटरी
(ii) मरकुरी सेल
(iii) फ्यूल सेल
(iv) जंग होना
Column II
(a) अधिकतम प्रभावकारीता
(b) गैल्वेनिज़ेशन से रोका जाता है
(c) स्थिर पोटेंशियल देता है
(d) $ज़्\text{ीन}$ एनोड है, $ज़्\text{ीनओ}_{२}$ कैथोड है
103
~~ 53. इस्तंभ I और इस्तंभ II के आइटम को मिलाएँ।
इस्तंभ I
(i) $κ$
(ii) $\Lambda_{m}$
(iii) $\alpha$
(iv) $Q$
इस्तंभ II
(a) $I \times t$
(b) $\Lambda_{m} / \Lambda_m^{0}$
(c) $\frac{\kappa}{c}$
(d) $\frac{G^{*}}{R}$
~~ 54. इस्तंभ I और इस्तंभ II के आइटम को मिलाएँ।
इस्तंभ I
(i) लेचलांच सेल
(ii) $निकेल-कैड्मियम$ सेल
(iii) फ्यूल सेल
(iv) मरकुरी सेल
इस्तंभ II
(a) सेल क्रिया $2 H_2+O_2 \longrightarrow 2 H_2 O$
(b) किसी समाधान में कोई आयन शामिल नहीं होने के बावजूद और इयरिंग एड में उपयोग होता है।
(c) पुनर्जीवित हो सकते हैं
(d) एनोड पर प्रतिक्रिया, $जिंक \longrightarrow जिंक^{२+}+2 ईवणः$
(e) ज्वालामुखी के ऊर्जा को विद्युतीय ऊर्जा में परिवर्तित करता है
~~ 55. नीचे दिए गए आधार पर इस्तंभ I और इस्तंभ II के घटकों को मिलाएँ:
$ E_{F_2 / F^{-}}^{\ominus}=2.87 V, E_{Li^{+} / Li}^{\ominus}=-3.5 V, E_{Au^{3+} / Au}^{\ominus}=1.4 V, E_{Br_2 / Br^{-}}^{\ominus}=1.09 V $
इस्तंभ I
(i) $F_2$
(ii) $Li$
(iii) $Au^{3+}$
(iv) $Br^{-}$
(v) $Au$
(vi) $Li^{+}$
(vii) $F^{-}$
इस्तंभ II
(a) धातु सबसे शक्तिशाली अधिकारी
(b) धातु आयन जो सबसे कम ऑक्सीकरणीय अधिकारी है
(c) गैर मेटल जो सबसे अच्छा ऑक्सीकरणीय अधिकारी है
(d) अरेखित धातु
(e) ज्युडाई को $Au^{3+}$ द्वारा ऑक्सीकरण कराया जा सकता है।
(f) उपाधि जो सबसे कम शक्तिशाली अधिकारी है
(g) धातु आयन जो एक ऑक्सीकरण कारक है
V. कथन और कारण प्रकार
नोट: निम्नलिखित सवालों में निर्णायक कथन के बाद एक कारण का निर्णय किया जाता है। निम्नलिखित विकल्पों में से सही उत्तर का चयन करें।
(i) कथन और कारण दोनों सत्य हैं और कारण कथन का सही स्पष्टीकरण है।
(ii) कथन और कारण दोनों सत्य हैं और कारण कथन का सही स्पष्टीकरण नहीं है।
(iii) कथन सत्य है, लेकिन कारण गलत है।
(iv) कथन और कारण दोनों गलत हैं।
(v) कथन गलत है, लेकिन कारण सत्य है।
~~ 56. कथन : कॉपर हाइड्रोजन की तुलना में कम उद्दीपनीय है।
कारण : $E_{Cu^{2+} / Cu}^{\ominus}$ नकारात्मक है।
~~ 57. कथन : सेल कार्य करने के लिए $E_{\text {Cell }}$ की पॉजिटिव मूल्य होनी चाहिए।
कारण : $E_{\text {Cathode}}<E_{\text {Anode}}$
~~ 58. कथन : सभी इलेक्ट्रोलाइटों की चालकता पतला होने पर कम होती है।
कारण : पतला करने पर यूनिट आयतन प्रति आयतन में आयनों की संख्या कम होती है।
~~
- असर : जब विलीन जलयात्रा तंत्र दिलुट किया जाता है, तो कमजोर वैद्युत लवणों के लिए $\Lambda_{m}$ में तेजी से वृद्धि होती है।
कारण : कमजोर वैद्युत लवणों के लिए विवरण अधिकता विलयन के साथ बढ़ती है।
~~ 60. असर : मर्क्युरी सेल स्थिर पोटेंशियल नहीं देता है।
कारण : सेल प्रतिक्रिया में, विलयनों को विलय में शामिल नहीं होता है।
~~ 61. असर : $NaCl$ विलय की विद्युतघटना $O_2$ के बजाय एनोड पर क्लोरीन देता है।
कारण : एनोड पर ऑक्सीजन का गठन अतिरिक्त वोल्टेज की आवश्यकता होती है।
~~ 62. असर : एक आइयनिक विलय की विद्युत प्रतिरोध को मापन करने के लिए एक एसी स्रोत का उपयोग किया जाता है।
कारण : यदि डीसी स्रोत का उपयोग किया जाएगा तो आइयनिक विलय की संचुरता बदल जाएगी।
~~ 63. असर : $E_{\text {Cell }}=0$ पर प्रवाह नहीं होता है।
कारण : सेल प्रतिक्रिया का समता प्राप्त हो जाता है।
~~ 64. असर : $Ag^{+} / Ag$ का $E_{Ag^{+} / Ag}$ $Ag^{+}$ आयनों की विलय की वृद्धि के साथ वृद्धि होता है।
कारण : $E_{Ag^{+} / Ag}$ का एक सकारात्मक मान है।
~~ 65. असर : तांबे के टरकण के लिए कॉपर सल्फेट संग्रहण किया जा सकता है।
कारण : तांबे से कम प्रतिक्रियाशील है।
उदाहरण समस्याएं, रसायन विज्ञान 42
VI. लांग आंसर प्रकार
~~ 66. चित्र 3.2 को ध्यान से देखें और निम्नलिखित प्रश्नों का उत्तर दें।
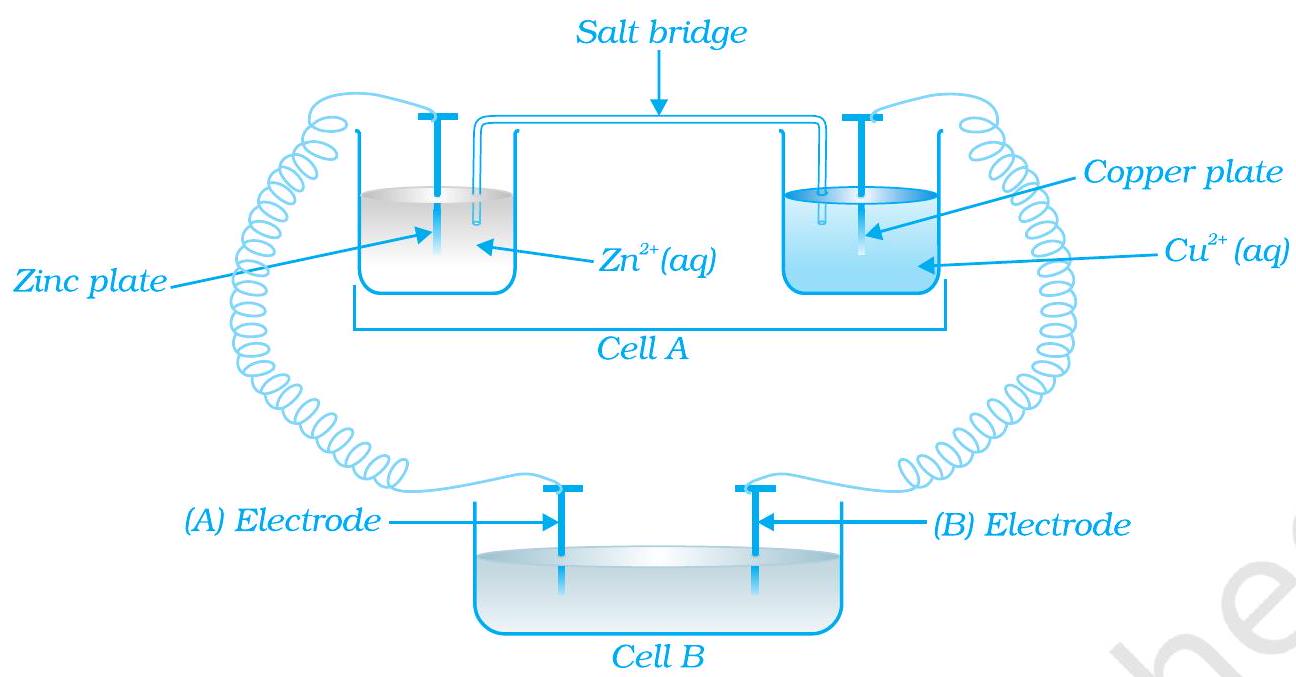
चित्र 3.2
(i) सेल ‘ए’ में $E_{\text {Cell }}=2 V$ है और सेल ‘B’ में $E_{\text {Cell }}=1.1 V$ है, इन दोनों सेलों में से कौन सेल ‘A’ या ‘B’ इलेक्ट्रोलिटिक सेल के रूप में कार्य करेगी। इस सेल में कौन सी इलेक्ट्रोड विद्रोह होंगी?
(ii) अगर सेल ‘A’ में $E_{\text {Cell }}=0.5 V$ है और सेल ‘B’ में $E_{\text {Cell }}=1.1 V$ है तो एनोड और कैथोड पर किन प्रतिक्रियाओं का होगा?
~~ 67. चित्र 3.2 को ध्यान से देखें और निम्नलिखित प्रश्नों के उत्तर दें (i) से (vi) तक।
(i) इलेक्ट्रॉन प्रवाह के दिशा दिखाने के लिए चित्र फिर से बनाएँ।
(ii) क्या चांदी की प्लेट एनोड या कैथोड है?
(iii) यदि बेंज़ीन मोच्छ साफ़ कर दिया जाए तो क्या होगा?
(iv) सेल कब कार्य करना बंद कर देगी?
(v) सेल कार्य करने पर $Zn^{2+}$ आयनों और $Ag^{+}$ आयनों की घनता पर कैसा प्रभाव पड़ेगा?
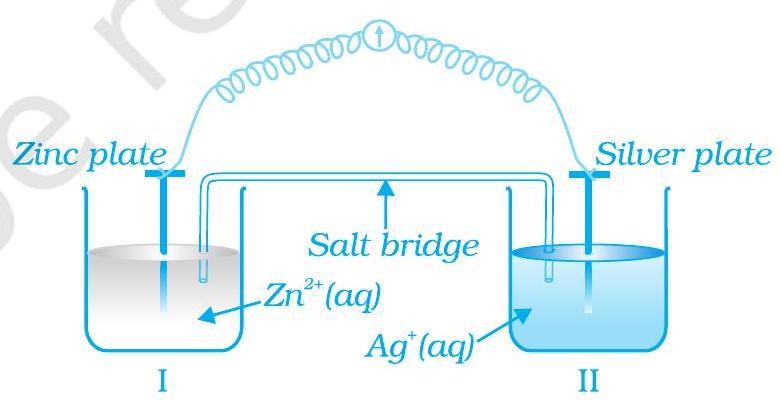
$${चित्र 3.3}$$
(vi) सेल ‘मृत’ हो जाने के बाद $Zn^{2+}$ आयनों और $Ag^{+}$ आयनों की घनता पर कैसा प्रभाव पड़ेगा?
~~ 68. गैल्वैनिक सेल में सेल प्रतिक्रिया की गिब्स मुक्त ऊर्जा और इलेक्ट्रोमोटिव बल के बीच क्या संबंध होता है? गैल्वैनिक सेल से अधिकतम कार्य कब मिलेगा?
जवाब
I. बहुविकल्पी प्रश्न (प्रकार-I)
~~
- (iii)
~~ 2. (ii)
~~ 3. (iii)
~~ 4. (ii)
~~ 5. (iv)
~~ 6. (iii)
~~ 7. (iii)
~~ 8. (ii)
~~ 9. (iii)
~~ 10. (ii)
~~ 11. (iv)
~~ 12. (i)
~~ 13. (iii)
~~ 14. (iv)
~~ 15. (i)
~~ 16. (ii)
~~ 17. (ii)
II. बहुविकल्पी प्रश्न (प्रकार-II) ~~ 18. (ii), (iv)
~~ 19. (i), (iii)
~~ 20. (ii), (iii)
~~ 21. (i), (ii)
~~ 22. (i), (iv)
~~ 23. (i), (iii)
~~
२४. (ि), (ई)
~~ २५. (ि), (ई)
~~ २६. (ि), (३) २७. (ई), (३)
३. संक्षेपिक प्रश्न प्रकार
~~ २८. नहीं
~~ २९. नहीं
~~ ३०. जब कोशिका प्रतिक्रिया संतुलन तक पहुंचती है।
~~ ३१. इसका अर्थ है कि $Zn$ हाइड्रोजन से अधिक सक्रिय है। जब जस्ता इलेक्ट्रोड को $SHE$ से जोड़ा जाएगा तो $Zn$ ऑक्सीडाइज होगा और $H^{+}$ को कम होगा।
~~ ३२. अलग, एनसीईआरटी पाठ्यपुस्तक देखें, पृष्ठ संख्या ८४।
~~ ३३. $Cu| Cu^{2+} || Ag^{+}| Ag$
~~ ३४. जलीय सोडियम क्लोराइड के इलेक्ट्रोलाइसिस की शर्तों के अंतर्गत, एणोड पर पानी का धातु विघटन अधिकारित करता है, इसलिए $Cl^{-}$ को पानी की जगह ऑक्सीडाइज़ किया जाता है।
~~ ३५. एनसीईआरटी पाठ्यपुस्तक देखें, पृष्ठ संख्या ६५।
~~ ३६. ‘ए’ का नकारात्मक ध्रुवीयता होगी
’ $बी$ ’ ध्रुवीयता होगी
~~ ३७. प्रतिध्वनि विद्युत को बरकरार रखने के लिए वायवीयता का उपयोग होता है, ताकि विधुत यों की संख्या उपादान में स्थिर रहे।
~~ ३८. एनसीईआरटी पाठ्यपुस्तक देखें, पृष्ठ संख्या ६४।
~~ ३९. संयंत्रित कोशिका में $NaOH$ बनते ही द्रव्यमान संतुलन बढ़ जाएगा।
~~ ४०. धातु यंत्रों की कुल क्रिया में आयन शामिल नहीं होते हैं।
~~ ४१. विलेयक ’ $बी$ ’ सुरम्य है क्योंकि हल्काने पर आयनों की संख्या वही रहती है, केवल इंटरआयनी आकर्षण कम हो जाती है, इसलिए मोल उच्चता में वृद्धि अल्प होती है।
~~ ४२. द्रव्यमान संतुलन को लेते हुए $[H^{+}]$ स्थिर रहने के कारण हल्काने पर द्रव्यमान $pH$ प्रभावित नहीं होगा।
एणोड पर : $2 H_2 O \longrightarrow O_2+4 H^{+}+4 e^{-}$
कैथोड पर $4 H^{+}+4 e^{-} \longrightarrow 2 H_2$
~~ ४३. विसंवादात्मकता कम होती है क्योंकि प्रति इकाई आयनों की संख्या कम होती है।
~~ ४४. मानक हाइड्रोजन विद्युत इलेक्ट्रोड संदर्भ इलेक्ट्रोड है जिसका इलेक्ट्रोड धातुक तापमान को शून्य माना जाता है। अन्य इलेक्ट्रोड का इलेक्ट्रोड धातुचुम्बकीय सामरिकी अपेक्षानुसार मापा जाता है।
~~ ४५. एणोड : $Cu \longrightarrow Cu^{2+}+2 e^{-}$
कैथोड: $\quad Cl_2+2 e^{-} \longrightarrow 2 Cl^{-}$
$Cu$ एणोड है क्योंकि यह ऑक्सीडाइज हो रहा है।
$Cl_2$ कैथोड है क्योंकि यह घटाव हो रहा है।
~~ ४६. $Zn+Cu^{2+} \longrightarrow Zn^{2+}+Cu$
$E_{ऊर्जा} =E ^{\ominus}_{ऊर्जा}-\frac{0.059}{2} \log \frac{[Zn^{2+}]}{[Cu^{2+}]}$
$E_{ऊर्जा}$ की मात्रा बढ़ती है जब $Zn^{2+}$ आयनों की घनता, $[Zn^{2+}]$ बढ़ती है।
~~ ४७. प्राथमिक बैटरियों में सीमित मात्रा के प्रतिक्रियकों का उपयोग होता है और उन्हें इस्तेमाल करने के बाद ये खात्म हो जाते हैं। सेकेंडरी बैटरियों को पुनर्चार्ज किया जा सकता है, लेकिन इसे चार्ज करने में लंबा समय लगता है। ईंधन कोशिका जब तक कि उसे ऊर्जा प्राप्त होती रहती है और उत्पाद खात्म होते रहते हैं तब तक लगातार चलती रहती है।
~~ ४८. $Pb+PbO_2+2 H_2 SO_4 \longrightarrow 2 PbSO_4+2 H_2 O$
विद्युत योजक का घनत्व समय के साथ कम होता है क्योंकि पानी बनता है और बैटरी के छार्ज करते समय साल्फ्यूरिक एसिड की खपत होती है।
~~ ४९. $CH_3 COOH$ के मामूली विद्युत विघटक के मामले में विद्युत विघटन की डिग्री में वृद्धि होने के कारण आयनों की संख्या में वृद्धि होती है।
$CH_3 COOH+H_2 O \rightarrow CH_3 COO^{-}+H_3 O^{+}$
मजबूत विद्युत विघटक के मामले में आयनों की संख्या वही रहती है, लेकिन इंटरआयनी आकर्षण कम हो जाती है।
IV. मिलाने वाले प्रकार
~~ ५०. (ि) $\rightarrow$ (क) (ii) $\rightarrow$ (ख)
कंटेंट का हिंदी संस्करण क्या है: (iii) $\rightarrow$ (a) (iv) $\rightarrow$ (b)
~~ 51. (i) $\rightarrow$ (d) (ii) $\rightarrow$ (a) (iii) $\rightarrow$ (b) (iv) $\rightarrow$ (c)
~~ 52. (i) $\rightarrow$ (d) (ii) $\rightarrow$ (c) (iii) $\rightarrow$ (a) (iv) $\rightarrow$ (b)
~~ 53. (i) $\rightarrow$ (d) (ii) $\rightarrow$ (c) (iii) $\rightarrow$ (b) (iv) $\rightarrow$ (a)
~~ 54. (i) $\rightarrow$ (d) (ii) $\rightarrow$ (c) (iii) $\rightarrow$ (a), (e) (iv) $\rightarrow$ (b)
~~ 55. (i) $\rightarrow$ (c) (ii) $\rightarrow$ (a) (iii) $\rightarrow$ (g) (iv) $\rightarrow$ (e) (v) $\rightarrow$ (d) (vi) $\rightarrow$ (b)
(vii) $\rightarrow$ (g) (f)
V. प्रयास करने और कारण प्रकार
~~ 56. (iii)
~~ 57. (iii)
~~ 58. (i)
~~ 59. (i)
~~ 60. (v)
~~ 61. (i)
~~ 62. (i)
~~ 63. (i)
~~ 64. (ii)
~~ 65. (iv)
V. लंबा उत्तर प्रकार
~~ 66. (i) कोशिका ’ $B$ ’ वैद्युतयास्क कोशिका के रूप में काम करेगी क्योंकि इसमें कम ईएमएफ होता है, इसलिए इलेक्ट्रोड अभिक्रियाएँ होंगी:
कैथोड पर $Zn^{2+}+2 e^{-} \longrightarrow Zn$
एनोड पर $Cu \longrightarrow Cu^{2+}+2 e^{-}$
(ii) अब कोशिका ‘B’ गैल्वेनिक कोशिका के रूप में काम करेगी क्योंकि इसमें अधिक ईएमएफ है और यह कोशिका ‘A’ में इलेक्ट्रॉन पदार्थों को धकेलेगी।
इलेक्ट्रोड प्रतिक्रिया होगी:
एनोड पर: $Zn \longrightarrow Zn^{2+}+2 e^{-}$
कैथोड पर: $Cu^{2+}+2 e^{-} \longrightarrow Cu$
~~ 67. संकेत: (i) इलेक्ट्रॉन्स $Zn$ से Ag में चलते हैं।
(ii) Ag धातु कैथोड है।
(iii) कोशिका का कार्य बंद हो जाएगा।
(iv) जब $E_{\text {cell }}=0$ होता है।
(v) $Zn^{2+}$ आयनों की घनत्व में वृद्धि होगी और $Ag^{+}$ आयनों की घनत्व कम होगी
(vi) जब $E_{\text {cell }}=0$ होता है तो संतुलन तक पहुंचा जाता है और $Zn^{2+}$ आयनों और $Ag^{+}$ आयनों की घनत्व बदलने की आवश्यकता नहीं होती है।





